|
Vernacular Name
Rana saltarina de muslos brillantes
State/Provinces
Napo, Orellana, Pastaza, Sucumbíos, Morona Santiago
Natural Regions
Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
Es una rana pequeña de dorso café claro u oscuro, con líneas dorsolaterales cremas o marrón claras, manchas amarillas o naranjas en la superficie dorsal de brazos y muslos y vientre crema a gris claro. Presenta ojos relativamente pequeños, una cabeza casi tan ancha como el cuerpo y dos escudos dermales en el extremo distal de los dedos. Se confunde con Ameerega hahneli, la cuál es ligeramente más pequeña, delgada, y con vientre azul y negro (el vientre de Allobates femoralis es crema a gris claro en su mitad posterior y gris obscuro a negro en su mitad anterior). Lithodytes lineatus también se asemeja en coloración dorsal, pero es más grande y tiene vientre café rojizo a gris con puntos claros dispersos; Lithodytes lineatus tiene manchas rojas grandes en los muslos (manchas amarillo brillante en Allobates femoralis).
Description
Es una especie de rana pequeña que presenta la siguiente combinación de caracteres ( 4, 5): (1) piel del dorso tuberculada; (2) hocico hundido y truncado, canto rostral angular y región loreal vertical; fosas nasales más próximas al hocico que al ojo, equivalente a la mitad del tamaño del ojo; (3) tímpano distintivo; (4) hendiduras vocales desconocido; (5) Dedo I de la mano más largo que el Dedo II; discos pequeños en los dedos de la mano y del pie; (6) membrana rudimentaria entre los dedos del pie; (7) tubérculos subarticulares pequeños; (8) dos tubérculos metatarsales muy pequeños.
Color in Life
Se caracteriza por tener un dorso café obscuro o café claro con líneas dorsolaterales cremas o marrón claras. Los lados de la cabeza son negros o café claros, excepto por una línea labial blanca que se extiende hasta el hombro. Los flancos son negros o café obscuros y tienen una banda crema desde el brazo o el flanco medio hasta la base del muslo. Hay manchas amarillas en las superficies dorsales del brazo y del muslo, cerca al hombro e ingle, respectivamente. Las manchas son rojas en el único individuo registrado en Lorocachi, Provincia de Pastaza (30). El vientre es crema a gris claro en su mitad posterior y gris obscuro a negro en su mitad anterior. Tiene discos digitales moderadamente expandidos. El iris es café (4).
Males Face Cloacal Length Average
Promedio = 20.7 mm (rango 15-23.9; n = 10) (30
Females Face Cloacal Length Average
Promedio = 23.1 mm (rango 18.7-24.9; n = 10) (30
Habitat and Biology
Es una especie diurna que vive en la hojarasca al borde o al interior de bosques primarios y secundarios (10, 12, 17).
Reproduction
Los machos son territoriales (0.25-26 m2) y cantan perchados en ramas bajas, especialmente después de las lluvias. Las hembras no son territoriales. El éxito reproductivo del macho tiene correlación con el tamaño de su territorio y con la actividad vocal. Durante la oviposición, el macho se sienta cerca, detrás o sobre la hembra. No existe amplexus cefálico. Depositan 8-43 huevos de 2.1 mm de diámetro en la hojarasca, los cuales eclosionan en unas dos semanas. Los renacuajos son transportados en el dorso del macho (ocasionalmente la hembra) a pozas temporales, riachuelos y cavidades de troncos (7, 11, 22, 26)
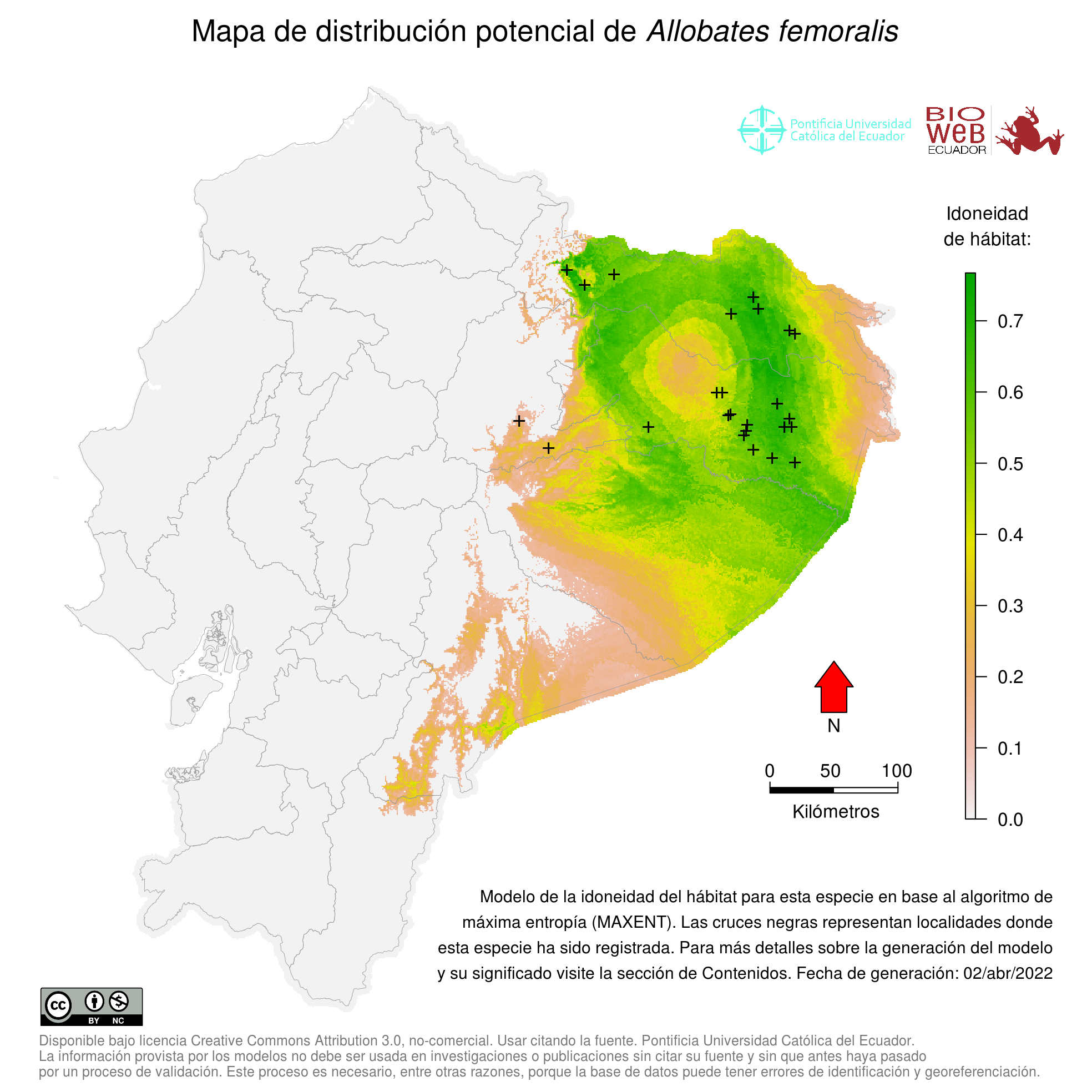
Distribution
Se distribuye en al noreste de la Cordillera de los Andes en Ecuador, en las provincias de Napo, Sucumbíos, Orellana, Pastaza y Morona Santiago (30).
Global Distribution
Altitudinal Range
En Ecuador, de 200 a 1000 m sobre el nivel del mar.
Taxonomy and Evolutionary Relationships
Allobates femoralis es la especie hermana de Allobates zaparo de acuerdo con la filogenia de Santos et al. (6) y Jetz y Pyron (31). Podría tratarse de un complejo de varias especies (6, 7, 19, 27). Véase sinónimos y comentarios taxonómicos en Frost (28).
Etymology
Del latín femor que significa muslo. Probablemente el nombre hace referencia a las conspicuas manchas amarillas de los muslos.
Additional Information
Gascon et al. (29) encontraron alta diversidad genética interpoblacional a lo largo del Río Juruá, Amazonía brasileña. Sin embargo, al probar la hipótesis del Río Juruá como barrera al flujo génico, encontraron poco soporte debido a que las poblaciones de ambos bancos del río fueron genéticamente similares (29). Vences et al. (24, 25), Summers y Clough (23), Santos et al. (1) y Grant et al. (7) proveen información filogenética y discuten aspectos de evolución de coloración y toxicidad. Duellman (12) y Rodríguez y Duellman (11) proveen descripciones morfológicas, datos de las vocalizaciones y el renacuajo. Castillo-Trenn (2) provee algunos datos de renacuajos. Zimmermann y Zimmermann (26) proveen datos de comportamiento. Lougheed et al. (19) usaron datos moleculares de Allobates femoralis para verificar dos hipótesis de diversificación en la Amazonía. Aguiar-Jr. et al. (13) proveen datos de la estructura cariotípica (2N = 24), de la posición de NORs y de la distribuición de la heterocromatina constitutiva. Aguiar-Jr. et al. (14) reportan espermatozoides biflagelados. Narins et al. (20, 21), Hödl et al. (18) y Amézquita et al. (15, 16) discuten aspectos de evolución de territorialidad, vocalización y agresión. Darst et al. (3) discuten la evolución de la dieta y toxicidad. Lötters et al. (8) dan una sinopsis de la especie con datos de distribución, hábitat, morfología, biología, crianza y reproducción, construcción de terrarios, dieta y aspectos taxonómicos. Presentan fotografías a color de un individuo de Perú (Departamento de Loreto), dos de Guyana Francesa (Arrondissement Cayenne), cinco de Brasil (Estados Pará, Amazonas y Rondônia) y uno de Ecuador (Provincia de Sucumbíos). Además proveen un oscilograma y espectrograma del canto de anuncio de un espécimen de Brasil (Estado de Amazonas). También proveen dos fotografías de posibles hábitats de los renacuajos.



Summary Author
Santiago R. Ron, Luis A. Coloma, Caty Frenkel, Cristina Félix-Novoa y Alexandra Quiguango-Ubillús
Editor
Santiago R. Ron
Edition Date
2011-08-24T00:00:00
Update Date
2022-10-05T20:46:51.937
Literature Cited
Santos, J. C., Coloma, L. A. y Cannatella, D. C. 2003. Multiple, recurring origins of aposematism and diet specialization in poison frogs. Proceedings of the National Academy of Sciences 100:12792-12797. Castillo-Trenn, P. 2004. Description of the tadpole of Colostethus kingsburyi (Anura: Dendrobatidae) from Ecuador. Journal of Herpetology 38:600-606.PDF Darst, C. R., Coloma, L. A., Menéndez-Guerrero, P. y Cannatella, D. C. 2005. Evolution of dietary specialization and chemical defense in poison frogs (Dendrobatidae): a comparative analysis. The American Naturalist 165:56-69.PDF Boulenger, G. A. 1884. On a collection of frogs from Yurimaguas, Huallaga River, Northern Peru. Proceedings of the Zoological Society of London 1883:635-638. Silverstone, P. A. 1976. A revision of the poison-arrow frogs of the genus Phyllobates Bibron in Sagra (Family Dendrobatidae). Science Bulletin. Natural History Museum of Los Angeles County 27:1-53.PDF Santos, J. C., Coloma, L.A., Summers, K., Caldwell, J. P., Ree, R., Cannatella, D. C. 2009. Amazonian amphibian diversity is primarily derived from late miocene andean lineages. PLoS Biol 7:3100005610.1371.1000056.PDF Grant, T., Frost, D. R., Caldwell, J. P., Gagliardo, R. W., Haddad, C. F. B., Kok, P., Means, D. B., Noonan, B. P., Schargel, E., Wheeler, W. C. 2006. Phylogenetic systematics of dart-poison frogs and their relatives (Amphibia: Athesphatanura, Dendrobatidae). Bulletin of the American Museum of Natural History 299:262.PDF Lötters, S., Jungfer, K., Henkel, F. W. y Schmidt, W. 2007. Poison frogs. Biology, species and captive husbandry. Edition Chimaira, Frankfurt am Main, Germany, 668 pp. Frank, N. y Ramus, E. 1995. Complete guide to scientific and common names of reptiles and amphibians of the world. N. G. Publishing Company, 377. IUCN, Conservation International y Nature Serve. 2004. Global Amphibian Assessment. www.globalamphibians.org. Consulta: 8 noviembre 2005. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Aguiar, J. O., Garda, A. A., Lima, A. P., Colli, G. R., Báo, S. N. y Recco-Pimentel, S. M. 2003. Biflagellate spermatozoon of the poison-dart frogs Epipedobates femoralis and Colostethus sp. (Anura, Dendrobatidae). Journal of Morphology 255:114-121. Aguiar, J. O., Lima, A. P., Giaretta, A. A. y Recco-Pimentel, S. M. 2002. A cytogenetic analysis of four poison frogs of the Epipedobates genus (Anura: Dendrobatidae). Herpetologica 58:293-303. Amézquita, A., Castellanos, L. y Hödl, W. 2005. Auditory matching of male Epipedobates femoralis (Anura: Dendrobatidae) under field conditions: the role of spectral and temporal call features. Animal Behaviour 70:1377-1386. Amézquita, A., Hödl, W., Lima, A. P., Castellanos, L., Erdtmann, L. y Carmozina de Araújo, M. 2006. Masking interference and the evolution of the acoustic communication system in the Amazonian dendrobatid frog Allobates femoralis. Evolution 60:1874-1887. Crump, M. 1995. Parental care, p. 518-567. In: Amphibian Biology. Vol. 2. H. Heatwole and B. Sullivan (eds.). Chipping Norton NSW, Australia. Hödl, W. , Amézquita, A. , Narins, P. 2004. The role of call frequency and the auditory papillae in phonotactic behavior in male dart-poison frogs Epipedobates femoralis.. Journal of Comparative Physiology A. 190:823-829. Lougheed, S. C., Gascon, C., Bogart, J. P. y Boag, P. T. 1999. Ridges and rivers: a test of competing hypotheses of Amazonian diversification using a dart-poison frog (Epipedobates femoralis). Proceedings of the Royal Society 266:1829-1835. Narins, P., Hödl, W. y Grabul, D. S. 2003. Bimodal signal requisite for agonistic behavior in a dart-poison frog, Epipedobates femoralis. Proceedings of the National Academy of Sciences 100:577-580. Narins, P., Grabul, D. S., Soma, K. K., Gaucher, P. y Hödl, W. 2005. Cross-modal integration in a dart-poison frog. Proceedings of the National Academy of Sciences 102:2425-2429. Roithmair, M. E. 1992. Territoriality and male mating success in the dart-poison frog, Epipedobates femoralis (Dendrobatidae, Anura). Ethology 92:331-343. Summers, K. y Clough, M. E. 2001. The evolution of coloration and toxicity in the poison frog family (Dendrobatidae). Proceedings of the National Academy of Science 98:6227-6232. Vences, M., Kosuch, J., Boistel, R., Haddad, C. F. B., La Marca, E., Lötters, S., Veith, M. 2000. Phylogeny and classification of poison frogs (Amphibia: Dendrobatidae), based on mitochondrial 16S and 12S ribosomal RNA gene sequences. Molecular Phylogenetics and Evolution 15:34-40. Vences, M., Kosuch, J., Boistel, R., Haddad, C. F. B., La Marca, E., Lötters, S., Veith, M. 2003. Convergent evolution of aposematic coloration in Neotropical poison frogs: a molecular phylogenetic perspective. Organisms Diversity and Evolution 3:215-226. Zimmermann, H. y Zimmermann, E. 1988. Etho-Taxonomie und zoogeographische Artengruppenbildung bei Pfeilgiftfröschen (Anura: Dendrobatidae). Salamandra 24:125-160. Clough, M. E. y Summers, K. 2000. Phylogenetic systematics and biogeography of the poison frogs: evidence from mitochondrial DNA sequences. Biological Journal of the Linnean Society 70:515-540. Frost, D. R. 2013. Amphibian Species of the World: an online reference. Version 5.6 (15 October, 2012). Base de datos accesible en http://research.amnh.org/vz/herpetology/amphibia/ American Museum of Natural History, New York, USA. Gascon, C., Lougheed, S. C., Bogart, J. P. 1998. Patterns of genetic population differentiation in four species of Amazonian frogs: a test of the riverine barrier hypothesis. Biotropica 30:104-119. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|
